胸痛を起こす病気の中で、命に関わる非常に重篤な病気としては、
- 急性冠症候群
- 大動脈解離
- 肺塞栓症
- 緊張性気胸
の4つが代表として知られており、早期診断・早期治療が非常に重要です。
今回は、中でも
- 胸や背部が裂けるように痛い。
- 痛みが移動するようだ。
という症状を来すことがある大動脈解離について、定義、分類、画像所見、治療法まで2020年度改訂の大動脈瘤・大動脈解離診療ガイドラインも踏まえてまとめました。
大動脈解離とは?
大動脈解離とは 簡単に言うと、大動脈の動脈の壁が裂けた状態です。
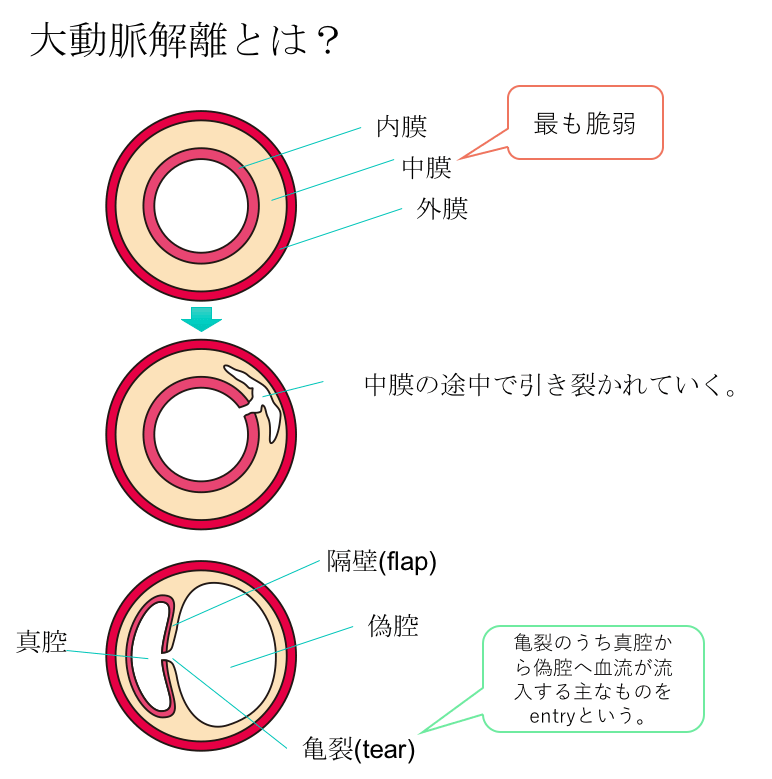
大動脈は、内膜、中膜、外膜の3層からなりますが、中膜は遺伝的素因などが原因となり、他の膜と比べてやや脆い傾向にあります。
そして高血圧などが原因となり、大動脈の壁に負担がかかると、内膜及び中膜の途中で大動脈が裂けてしまうことがあります。これを大動脈解離と言います。
本来の正常な大動脈腔を真腔(true lumen)、裂けて新たにできた大動脈腔を偽腔(false lumen)と言います。
大動脈解離の症状は?
症状は以下のような重たい症状が起こることが多いです。
- 突然の胸背部痛(裂けるような痛み、移動するような痛みと訴えることもある)
- 意識障害、失神
- 神経障害
ただし、高齢者の場合、症状に気づかないこともあるので注意が必要です。
大動脈解離の分類は?
大動脈解離の分類は、
- 偽腔の血流状態
- 解離範囲
- 発症からの病期
により分類されます。
発症からの時間による分類は?
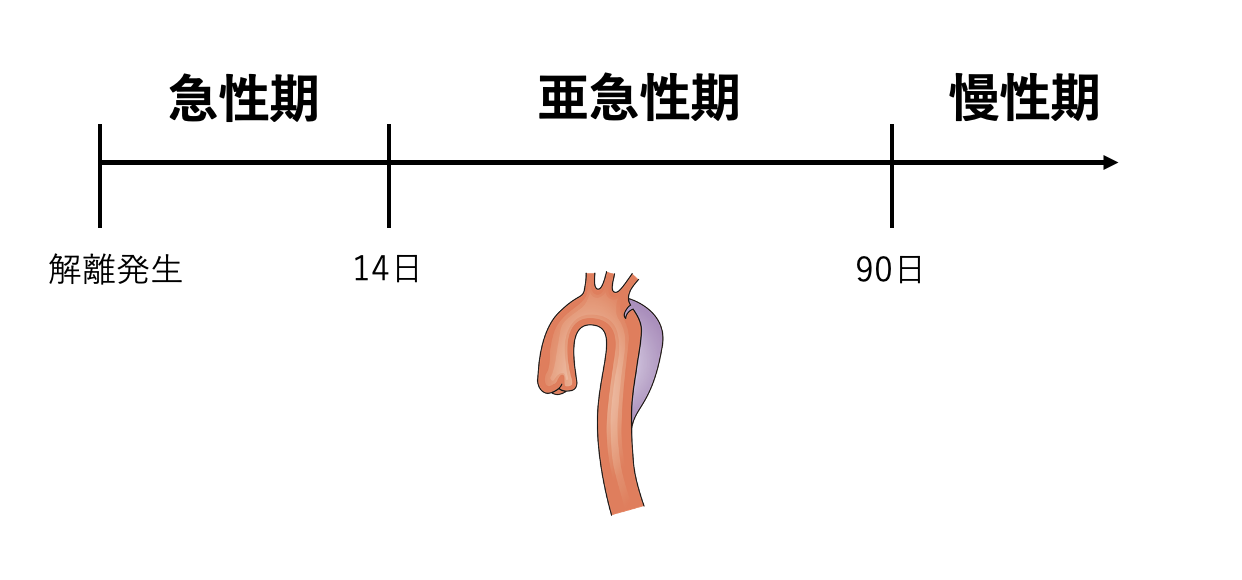
- 急性期:14日以内
- 亜急性期:15日〜90日以内
- 慢性期:90日以降
と2020年のガイドラインで亜急性期が分類されるようになりました。
偽腔の血流状態による分類は?
偽腔の血流状態による分類は、
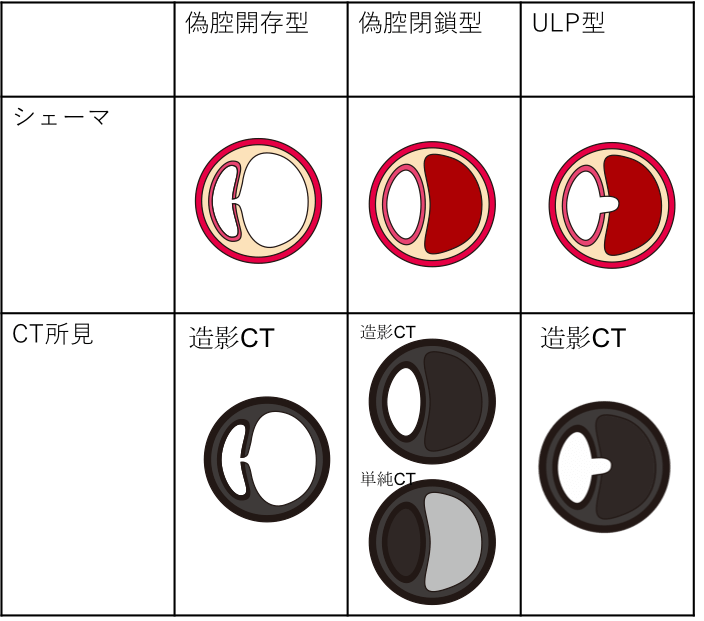
- 偽腔開存型
- 偽腔閉鎖型
- ULP型
の3つに分けられます。
以下詳しく見ていきます。
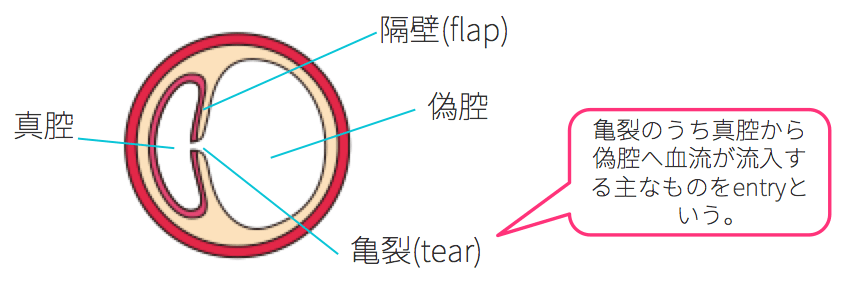
大動脈解離は、中膜の途中で大動脈壁が裂ける病気でした。そして、裂けてできた内膜と中膜の一部は、隔壁(フラップ、flap)と呼ばれます。
この隔壁(フラップ、flap)には、1~数個の内膜の亀裂(tear)が存在すると言われています。亀裂が存在すればこれを介して真腔(true lumen)と偽腔(false lumen)が交通することになりますが、この亀裂がはっきりしないこともあります。
交通する場合を、
- 偽腔開存型大動脈解離(communicating aortic dissection)
交通しない場合を、
- 偽腔閉鎖型大動脈解離(non-communicating aortic dissection)
と分類します。
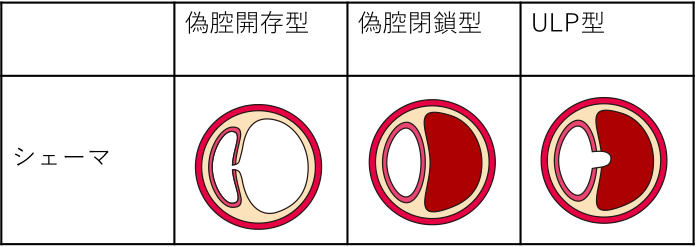
偽腔に血流があるかどうかで分類します。
特殊なタイプとして、偽腔閉鎖型解離において、血栓のある偽腔へ局所的な内腔の突出を認めることがあります。これを、
- ULP (ulcer-like projection)
と分類します。読み方は、そのままユーエルピーです。
このULPには注意が必要です。なぜならば、経過を見ていると
- 解離腔が拡大したり、瘤化する。
- 再度解離をする。
- 大動脈が破裂する。
というリスクが他のタイプよりも高いとされているためです。
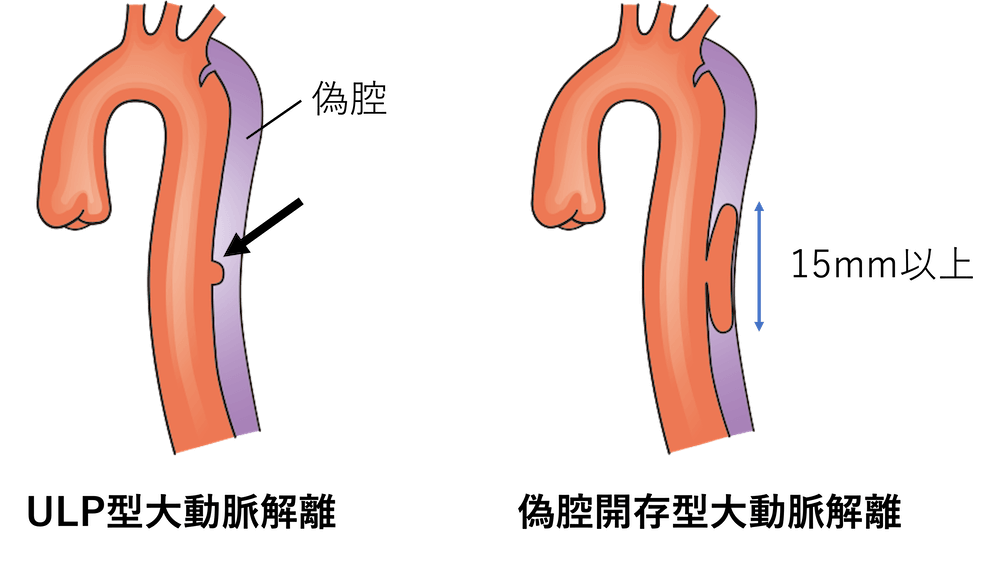
ただし、2020年のガイドラインで頭尾方向への広がりが15mm未満であることが定義されました。それ以上の場合は偽腔開存型になります。
ULPと似ているIBPとは?
閉塞した偽腔内に造影剤がプーリングする病態を壁内血液貯留(intramural blood pooling:IBP)と呼び、画像上、ULPとの鑑別が困難なことがあります。
その形態から明らかにIBPと判断される場合にはULPから除外します。
ULPは不安定な病態であるのに対し、15mmを超えないIBPは自然に退縮して予後良好です。
IBPの画像特徴
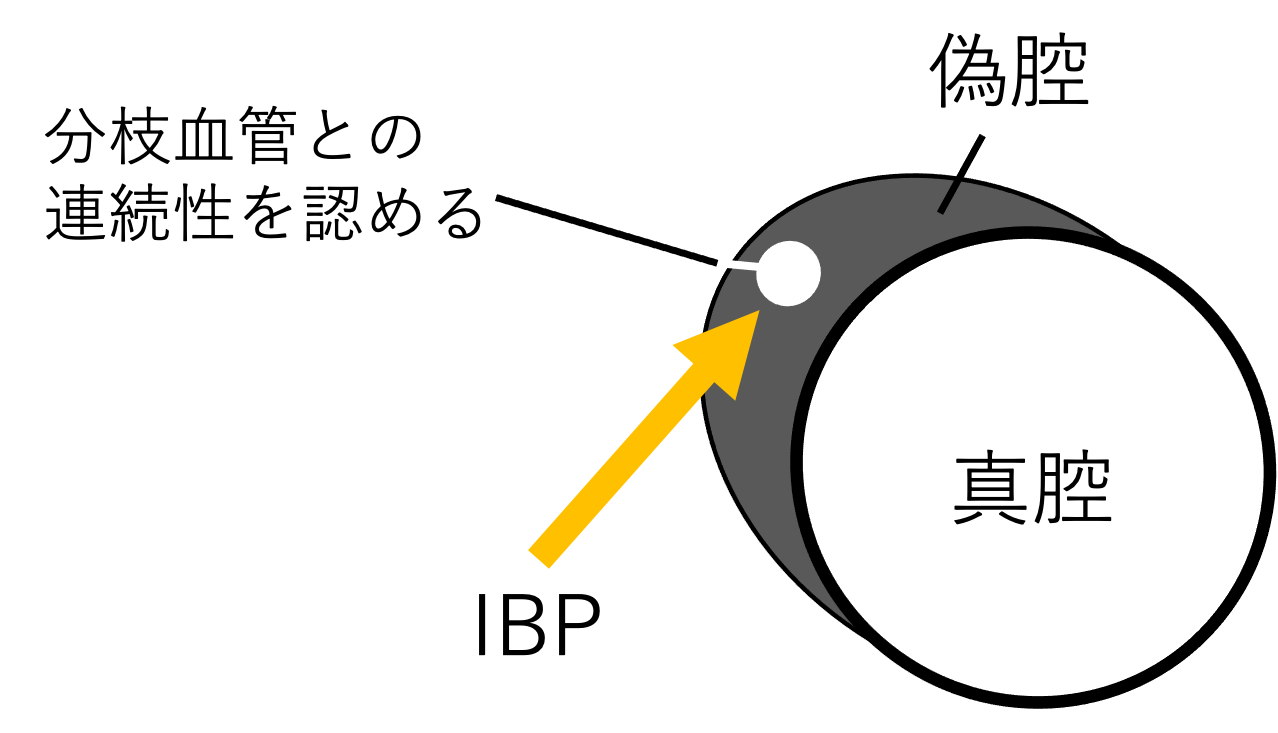
- 偽腔内血栓に島状の造影域として描出されること
- 偽腔外膜側に孤立性に形成されること
- 分枝血管との連続性を認めること
などが挙げられますが、空間分解能の点からULPとIBPを厳密に区別できないこともあります。
IBPができる機序

肋間動脈などが大動脈から分枝しているところに、大動脈解離が起こり偽腔ができます。
そうすると分枝血管が引き離され(断裂し)ます。
その血管から逆流した血液が偽腔に貯留することがあり、これがIBPとなります。
entryとは?
entry(入口部)とは、tear(亀裂)の中でも真腔から偽腔へ血流が流入する主なものを指し、initial tear、primary tearと呼ばれることもあります。
また、真腔から偽腔へ血流が再流入する場合があり、このtear(亀裂)をre-entry(再入口部)と呼びます。
解離範囲による分類は?
解離範囲による分類は2種類あります。
- Stanford分類
- DeBakey分類
の2種類です。それぞれ読み方はスタンフォード、ドゥベーキーです。
Stanford分類とは?
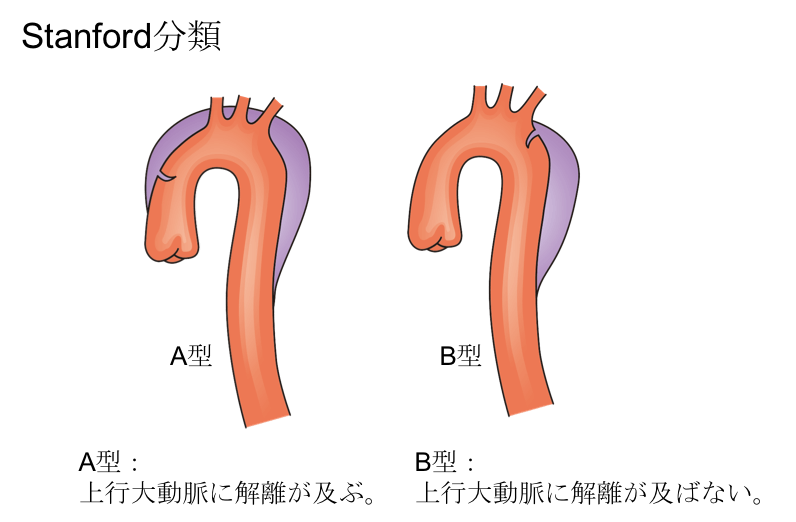
Stanford分類は、上行大動脈に解離が及んでいるかどうかで、分類するわかりやすい分類です。
- Stanford分類A型:上行大動脈に解離が及ぶ。
- Stanford分類B型:上行大動脈に解離が及ばない。
当然心臓により近いところまで解離が及んでいるA型の方が重要であり、緊急手術の適応となります。治療方針に直結する分類であるため、救急の現場では、こちらの分類が基本的に使われます。
DeBakey分類とは?
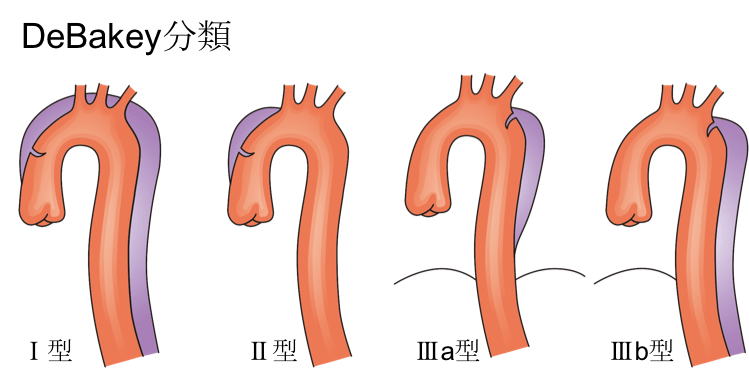
一方でDeBakey分類は少しややこしく、解離の範囲と、entryの位置により分類します。こちらは、解離範囲を具体的に示したものであり、心臓血管外科が手術する場合や血管内治療の際に有用な分類とされます。
詳細については成書を参考ください。
大動脈解離ってどうやって診断する?
まず上に挙げた症状から、大動脈解離の可能性を疑います。
通常は、その後、診察や、採血などの初期対応に加えて、胸部レントゲン検査を撮影されます。大動脈解離の場合は、
- 胸部レントゲンで縦隔の陰影が増強する。(縦隔が通常よりも太く見える)
という所見が見られます。
症状とレントゲン所見の組み合わせでいかにこの病気を疑うかが重要です。
以下の3つ当てはまれば100%、2つ以上なら83%で大動脈解離と診断できる。
- 裂けるような痛み
- 痛みの移動
- 胸部X線で上縦隔拡大
ただし、この所見は大動脈解離があっても全例に見られるわけではありませんので、疑わしい場合積極的に精査が必要です。その精査が、CT検査です。
大動脈解離のCT所見は?
大動脈解離が疑われる場合は、単純CTのほか、造影剤を使った造影CTを撮像することが望まれます。
CTでは、
- 解離腔があること(存在診断)。
- 解離腔の形態及び進展範囲(性状診断)。
- entry/ re-entryの同定(造影CTによる)。
- 合併症の有無
- 大動脈の破裂
- 心タンポナーデ
- 大動脈の主要分枝動脈の閉塞(及びそれによる臓器虚血):冠動脈、弓部3分枝、腹腔動脈、上腸間膜動脈、腎動脈、総腸骨動脈など。
などをチェックします。
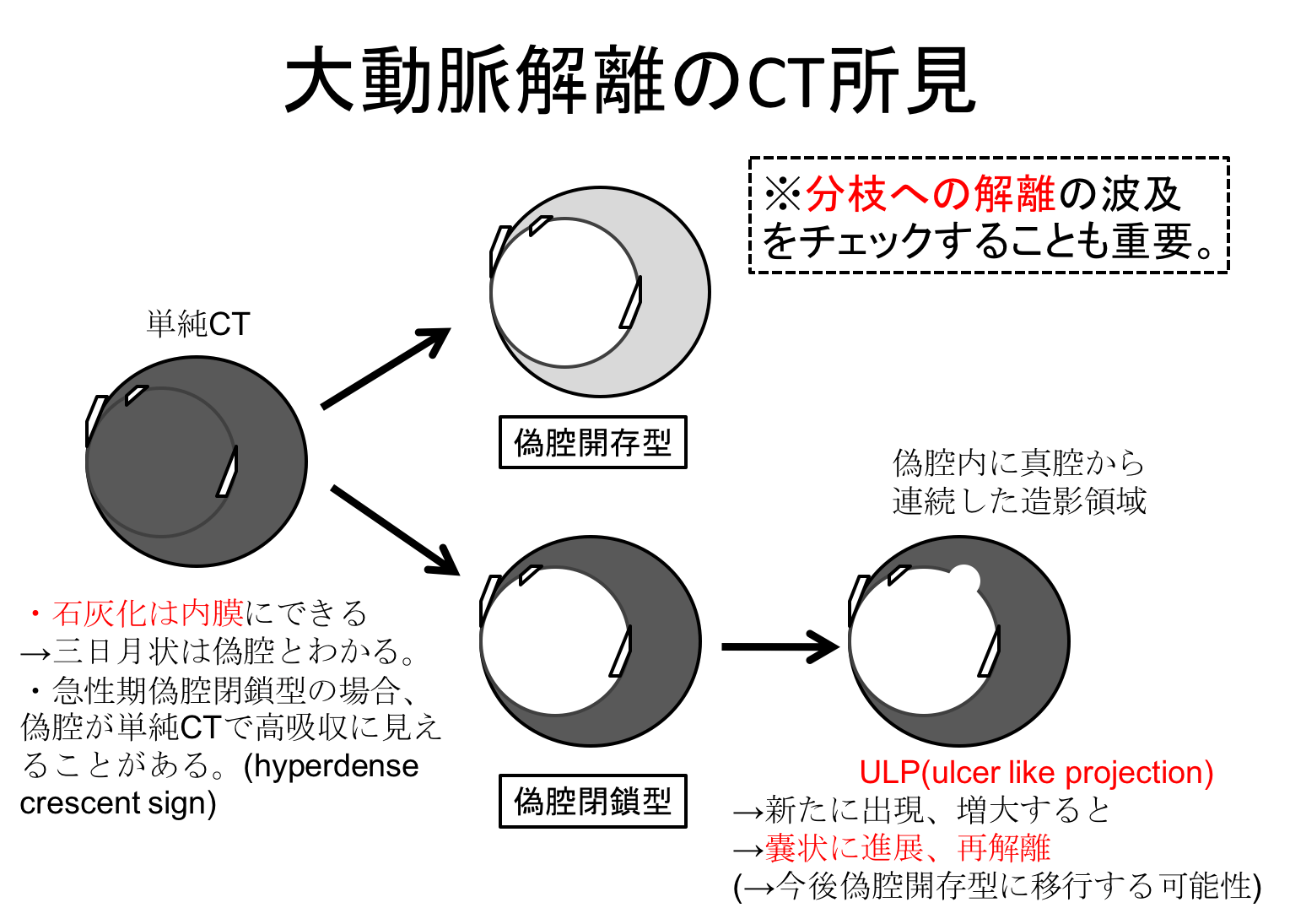
単純CTを必ず撮影します。
単純CTで石灰化を有する内膜が内腔に偏位していることから大動脈解離を疑うことができます。(ただし、壁在血栓や粥腫に新たな内膜が張って来て石灰化を来すこともあるので、石灰化の偏位があれば必ず解離というわけではないので注意。)
その際に急性期の偽腔閉鎖型の場合は偽腔が単純CTで高吸収となることがあり、これをhyperdense crescent signといいます。(逆に低吸収の場合は急性期でない可能性が高くなる)
続いて造影CTでは偽腔開存型の場合は、偽腔に造影効果を認めますが、偽腔閉鎖型の場合は認めません。
偽腔閉鎖型であっても、偽腔に突出像を認めた場合は、ULP型と診断できます。
ただし前述したようにこの突出像が頭尾方向に15mmを超えるものはULP型ではなく偽腔開存型の大動脈解離と診断するように2020年のガイドラインから変更がありました。
それぞれのタイプをシェーマおよびCT画像所見で表すと次のようになります。
では実際の画像を見てみましょう。
症例 60歳代男性 胸痛
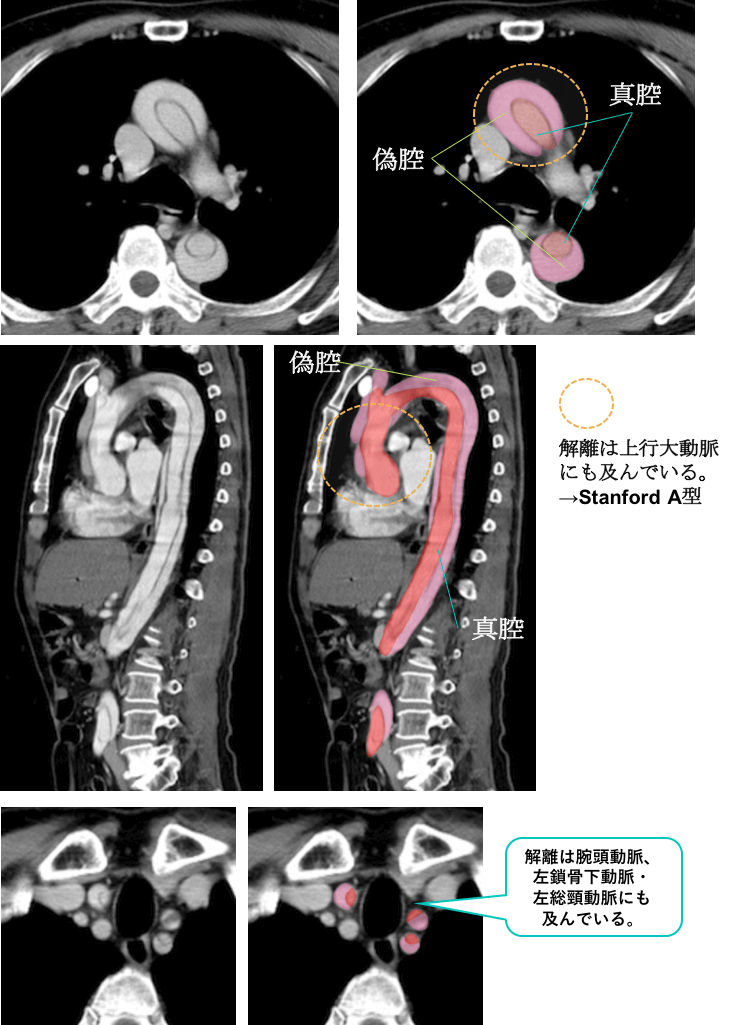
胸腹部造影CTの画像です。
上行大動脈および胸部下行大動脈に解離が及んでおり、(矢状断像でも明らかです)、Stanford A型の大動脈解離であることわかります。
また偽腔には造影効果を認めており、開存していることがわかります。
偽腔開存型大動脈解離(Stanford A型)と診断されました。
なお、解離腔は、腕頭動脈、左鎖骨下動脈・左総頸動脈にも及んでいることがわかります。
症例 40歳代男性 胸痛
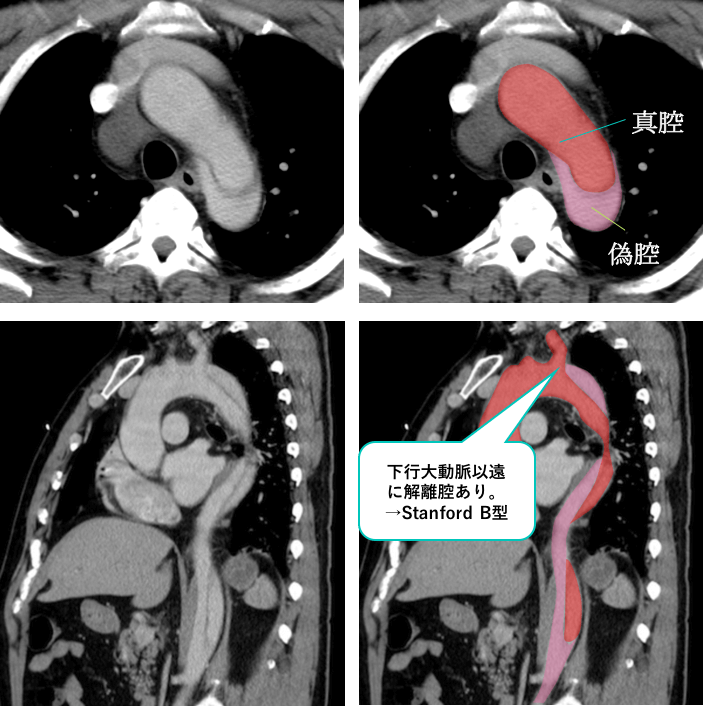
胸部造影CTです。
解離腔を認めていますが、下行大動脈以遠から認めていることがわかります。
また、偽腔は開存しています。
偽腔開存型大動脈解離(Stanford B型)と診断されました。
症例 60歳代男性
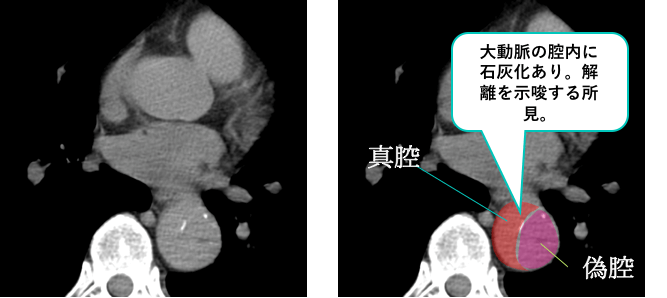
胸部単純CTの横断像です。
胸部下行大動脈の腔内に石灰化を認めており、解離を示唆する所見です。
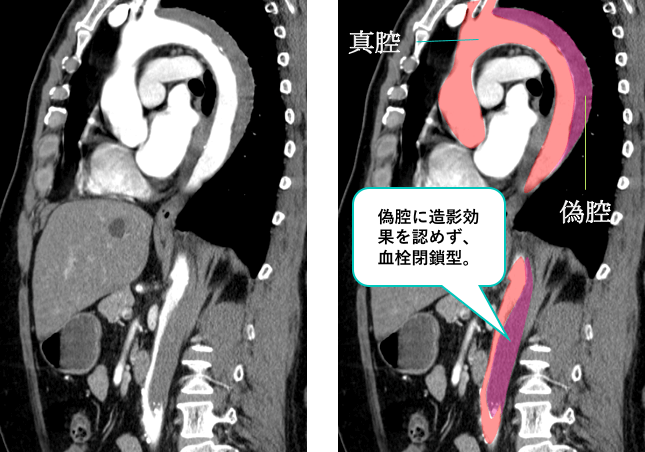
造影CTの矢状断像です。
偽腔には造影効果を認めておらず、偽腔閉鎖型であること、下行大動脈以遠から解離腔を認めており、Stanford B型であることがわかります。
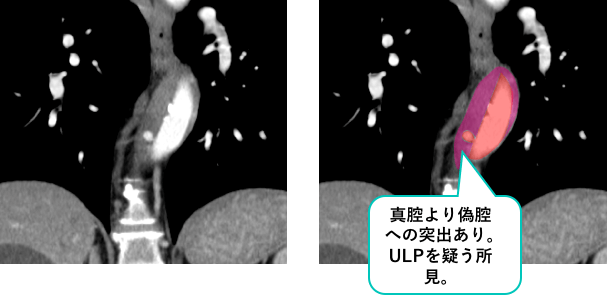
造影CTの冠状断像です。
さらにこの症例では、真腔から偽腔への突出像を認めており、ULPを疑う所見を認めています。
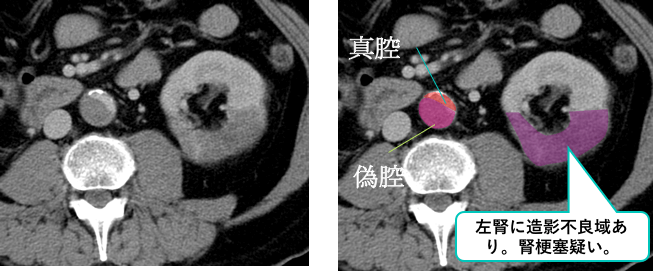
また左腎に造影不領域を認めており、腎梗塞の合併が疑われます。
偽腔閉鎖型(ULP型)大動脈解離(Stanford B型)、腎梗塞合併と診断されました。
ULPは解離腔が拡大したり、瘤化、破裂のリスクがありますので、この症例で見られたようなULPがないかをチェックすることは重要です。
症例 80歳代男性
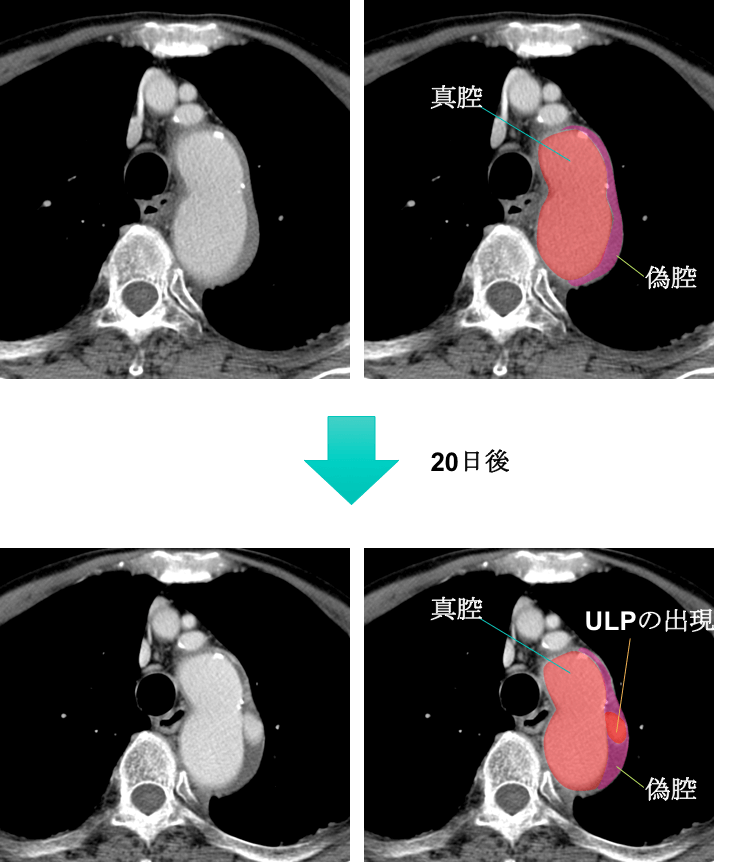
偽腔閉鎖型大動脈解離と診断され、下の画像は20日後のCT画像です。
偽腔にULPが出現していることがわかります。
偽腔閉鎖型(ULP型)大動脈解離(Stanford B型)と診断されました。
症例 70歳代 男性
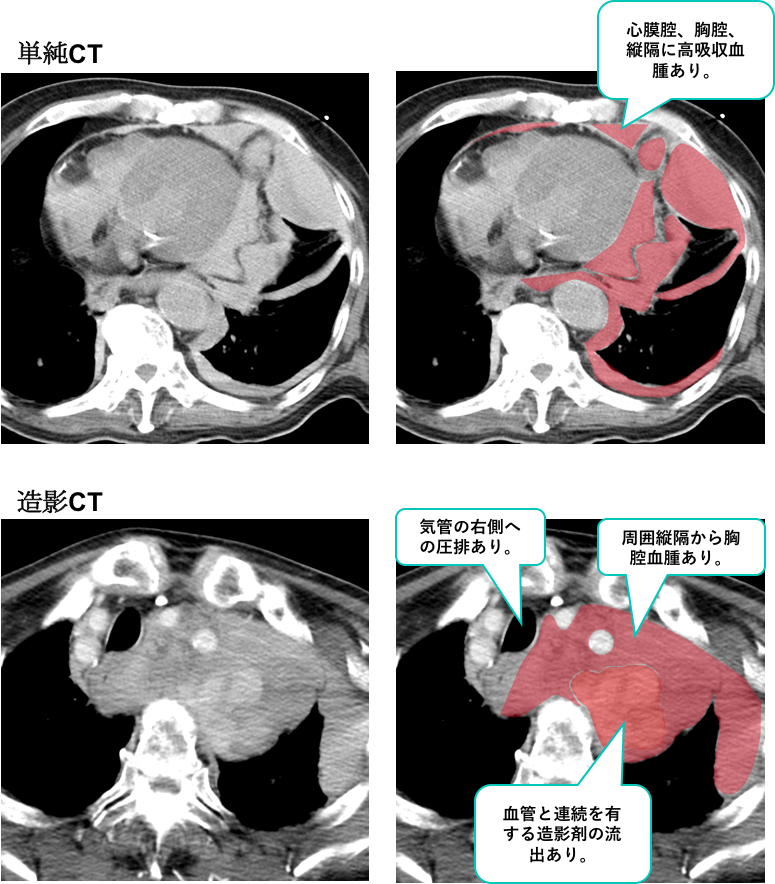
上が単純CT、下が造影CTです。
単純CTでは、造影剤を用いていないのに、心膜腔、胸腔、縦隔に高吸収血腫を認めています。
大動脈の破裂を疑う所見です。
造影CTでは、血管と連続を有する造影剤の流出を認めており、同部での破裂が疑われます。
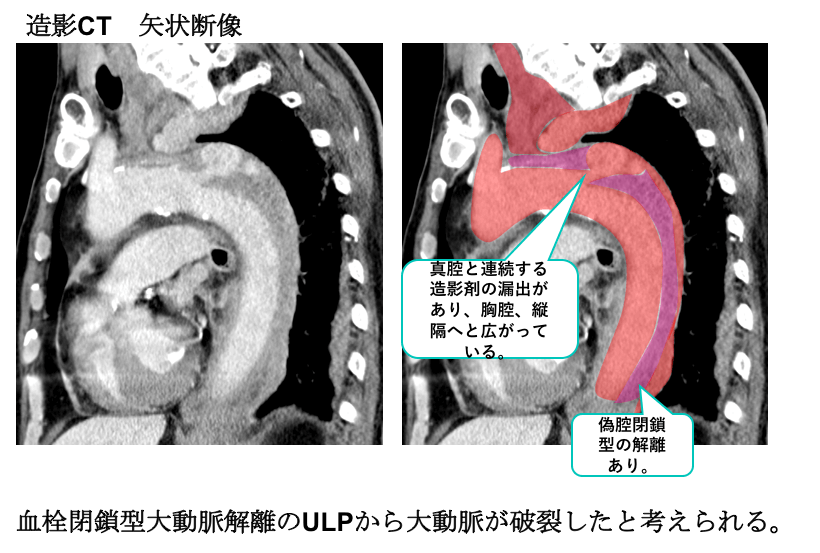
造影CTの矢状断像では、真腔と連続する造影剤の漏出を認めており、ここから胸腔や縦隔へ広がっていることがわかります。
偽腔閉鎖型の大動脈解離がベースにあり、ULPから破裂したことが疑われます。
大動脈破裂(偽腔閉鎖型大動脈解離(ULP型)に合併)と診断されました。
大動脈解離の治療は?
まず大動脈解離が疑われると、造影または単純CTで急性大動脈解離と診断するという流れになります。
大動脈解離の治療は、上述のように上行大動脈に解離腔が及ぶが及ばないかで異なります。
急性期大動脈解離の場合
急性期の場合、
- StanfordA型(上行大動脈に解離腔が及ぶ)→心臓血管外科にて緊急手術。ただし以下の例外あり。
- StanfordB型 (上行大動脈に解離腔が及ばない)→保存的に点滴などで加療。(但し近年はいかに記載しているように合併症の有無で治療方針が異なる)
となりますが、
発症から2週間以上経過したStanford A型の場合も、保存的に点滴などで加療されます。また、急性期であっても、偽腔閉鎖型の解離の場合は(欧米と異なり)本邦ではStanford A型に対しても内科的に加療されることがあります。
大動脈解離の治療において大事な点は、
- 血圧コントロール(血圧を下げる)
- 疼痛コントロール(痛みを和らげる)
という2点です。
近年はStanfordB型でも侵襲的治療を行うことがある!
従来、StanfordB型では保存的治療が原則でしたが、ステントグラフト使用が近年増加しています。
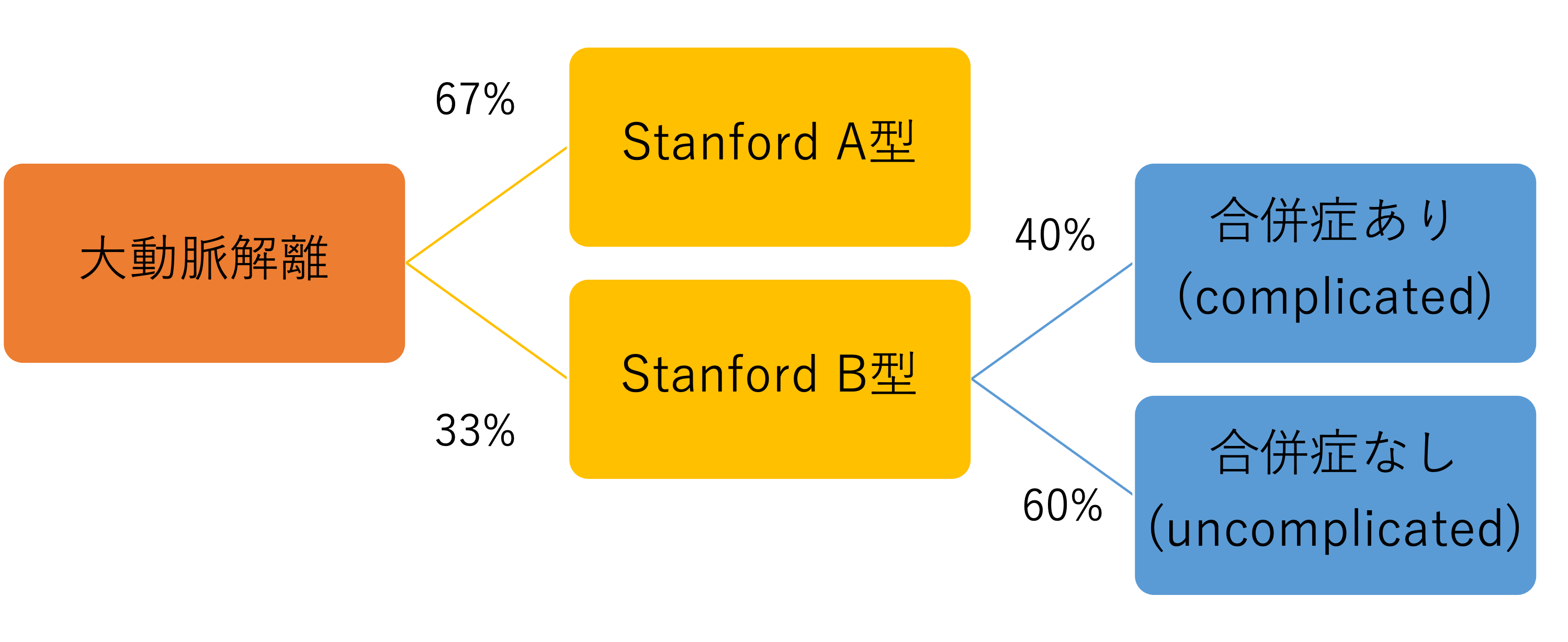
StanfordB型の大動脈解離の治療を考える上で重要なのは、
- 合併症のある大動脈解離(complicated AD)
- 合併症がない解離(uncomplicated AD)
いずれであるかを見極めることです。
なぜこのように分類する必要があるかというと治療方針に関わってくるためです。
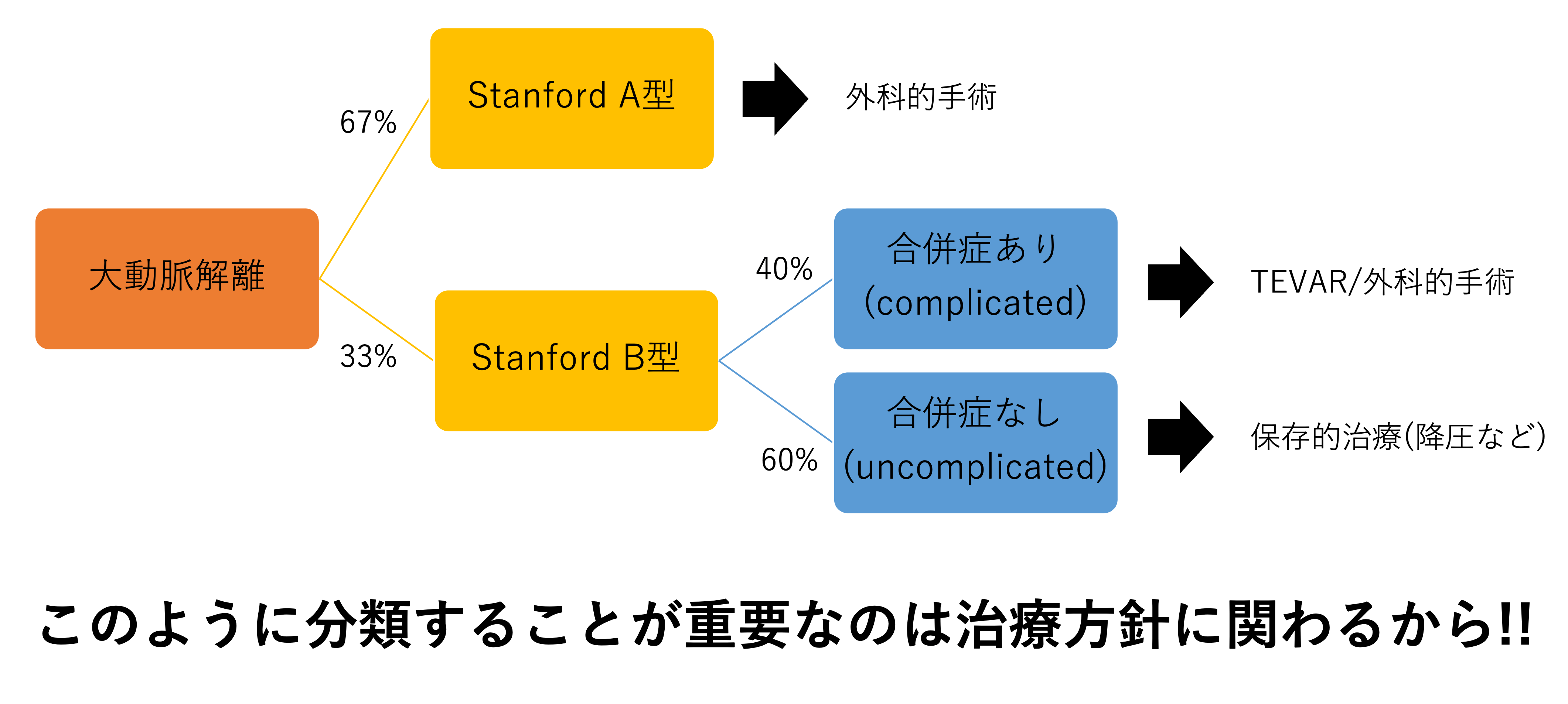
ガイドライン上の定義では、合併症のある急性大動脈解離(complicated AD)というのは
- 破裂(rupture)や切迫破裂(impending rupture) →治療の適応
- 臓器灌流不全(Malperfusion) :腹部の重要な分枝、下肢、脊髄など→ 治療の適応
- 持続する痛みや再発する痛み
- コントロール不能な高血圧
- 大きな大動脈径や真性動脈瘤に合併した解離、急速に大きくなる解離
といった5つの定義があります。
その中で実際に治療の適応となってくるのは、1,2の2つです。
そして、合併症のある急性期大動脈解離、亜急性期では、手術ではなく、ステントグラフト治療(TEVAR:thoracic endovascular aortic repair)を第一選択にするという点が、2020年度改訂の大動脈瘤・大動脈解離診療ガイドラインにおける重要な変更点となります。
破裂(rupture)を示唆するCT画像所見
ステントグラフト治療の適応となるruptureを示唆する画像所見としては、
- 縦隔や胸腔内、あるいは後腹膜に血腫を形成する
- 大動脈壁の不整
- 造影剤の血管外漏出
といったものがあります。
臓器灌流不全(Malperfusion)を示唆するCT画像所見
臓器灌流不全(Malperfusion)を示唆するCT画像所見としては、2つの有名な血管の閉塞のパターン
- 動的閉塞(Dynamic obstruction)
- 静的閉塞(Static obstruction)
があります。
動的閉塞(Dynamic obstruction)は、偽腔が拡張して真腔を圧排し、真腔から出る分枝を圧排して臓器灌流不全(malperfusion)が起こるもので、entryを閉じて真腔の血流を増やす治療が施行されます。
一方、静的閉塞(Static obstruction)は、大動脈解離が大動脈の分枝に及ぶことで狭窄を起こし臓器灌流不全(malperfusion)が起こるもので、狭くなった分枝にステント留置がなされたり、entryを閉じて真腔の血流を増やす治療が施行されます。
合併症がないStanford B型解離でも侵襲的治療がなされることがある。
合併症がないStanford B型急性大動脈解離は内科治療を行う(推奨クラスⅠ)となっていますが、将来拡大が予想される症例に対しては亜急性期または慢性早期に予防的TEVARを考慮するが推奨クラスⅡaとなっています。
慢性期偽腔拡大の予測因子としては、
- 年齢<60歳
- 心拍数≧60/min
- Marfan症候群と遺伝性大動脈疾患
- FDP≧20μg/ml
- 大動脈径≧40mm
- 楕円形の真腔/円形の偽腔
- 偽腔の開存
- 小弯側の偽腔やentry
- 偽腔の部分血栓閉塞
- 単独のentry
- 偽腔径≧22mm
- large entry≧10mm
があります。
慢性期の大動脈解離の場合
慢性期の大動脈解離の場合、初診から3〜6ヶ月後にCTを再検します。
瘤径が60mm以上、もしくは半年で5mm以上になれば侵襲的治療(TEVAR:thoracic endovascular aortic repairなど)を推奨します。
そうでない場合は、45mm未満では1年ごと、45〜55mm未満では3〜6ヶ月ごとにCT検査をするように述べられています。
血圧コントロールの具体的な治療薬は?
ペルジピン®持続点滴(5~15mg/時、0.5~6μg/kg/min)
※ペルジピン 1/2A の静脈注射を繰り返すという大雑把なものでもOKと言われています。
※ペルジピンの代わりに、ヘルベッサ-、ミリスロールを用いることもある。。
疼痛コントロールの具体的な治療薬は?
- 塩酸モルヒネ®(10mg/1ml/A) 2mg(0.2ml)静注 計5~10mg
- ペンタジン®0.2mg(0.5~1A) ゆっくり静注
この1もしくは2を用いて疼痛の緩和を図ります。
最後に
命に関わる非常に重要な疾患である大動脈解離についてまとめました。
突然発症の、裂けるような胸の痛みというのが典型的な症状ですが、特に高齢者の場合、これらの症状が典型的に出ない場合があります。
症状が出なくても命に関わることには変わりありません。
大動脈解離は、いかに早くこの病気を疑って、造影CTまでの精査ができるかが非常に重要とも言える病気です。
診断のポイントになる画像所見など中心にまとめました。
ぜひ参考になれば幸いです<(_ _)>
関連記事:TEVAR、EVAR後のエンドリークのタイプと画像診断のポイント!
ご案内
腹部画像診断を学べる無料コンテンツ
4日に1日朝6時に症例が配信され、画像を実際にスクロールして読影していただく講座です。現状無料公開しています。90症例以上あり、無料なのに1年以上続く講座です。10,000名以上の医師、医学生、放射線技師、看護師などが参加中。胸部レントゲンの正常解剖を学べる無料コンテンツ
1日3分全31日でこそっと胸部レントゲンの正常解剖の基礎を学んでいただく参加型無料講座です。全日程で簡単な動画解説付きです。
画像診断LINE公式アカウント
画像診断cafeのLINE公式アカウントで新しい企画やモニター募集などの告知を行っています。 登録していただくと特典として、脳の血管支配域のミニ講座の無料でご参加いただけます。
