アルツハイマー病(AD:Alzheimer disease)
・痴呆の原因疾患で最も多い。物忘れを主訴として発症する。
・ 2番目に多い痴呆を来す疾患は、Lewy小体型痴呆(DLB)。
・組織学的には老人斑(神経毒性を持つアミロイドβ蛋白でできる)、神経原線維変化(タウ蛋白が過剰にリン酸化されてできる)の2つが見られる。なかでも後者の神経原線維変化の方は、神経細胞脱落と正の相関を示し、認知症と相関するとされる。
・つまり、ADのstageが上がる程、タウ蛋白の沈着は増大する。海馬から始まり、側頭葉→頭頂葉への沈着の広がりあり。
・記銘力障害(新しいことが覚えられない)で始まる
→やがて認知障害(見当識障害)と人格障害
→ついに高等感情が鈍麻し、意思疎通が不能になる。
・病期は20年以上におよぶ事も珍しくない。
・家族性AD、若年性ADなど多様な病態があり、臨床所見、経過、倫理的側面も考慮した遺伝子情報などを加味した視点が診断に不可欠。
・治療薬はコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミンの3種類、アセチルコリンの濃度を高めて、神経伝達効率を高める)、NMDA受容体拮抗薬(メマンチン。ドネペジルとの併用も可能。)
アルツハイマー病と脳血管障害の関係
・潜在的なアルツハイマー病があり、それに脳血管障害が加わると、アルツハイマー病が顕在化することあり。
・すでにアルツハイマー病を発症しており、それに脳血管障害が加わると、アルツハイマー病による認知症が悪化する。
・つまり、アルツハイマー病に脳血管障害が加わると進行する。
ADの診断基準
・2011年にThe National Institute on Aging Alzheimer’s Association(NIA/AA)から提出された。
・ADには、「発症前」、「軽度認知機能障害(mild cognitive impairment:MCI)」、「認知症」を示す段階がある。
・複数のバイオマーカーにより診断確実度が評価される。
・ADには病理的な一連のプロセスがあり、そのステージ毎に適切なバイオマーカーが選択されるべき。
▶バイオマーカー
- 原因遺伝子変異(APP,PS-1/PS-2)、危険因子(APOE4)の検索
- 脳脊髄液 Aβ42低下
- 脳脊髄液 tau/p-tau増加
- アミロイドPET陽性
- FDG-PET代謝低下(ただし、保険診療が認められていない)
- MRIでの海馬近傍萎縮
画像所見のポイントは?
▶MRI所見
・病期によって、その様相は大きく異なる。
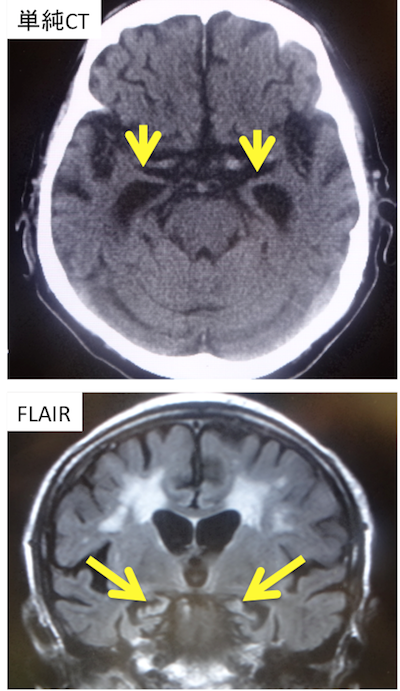
・嗅内野皮質、海馬、扁桃体萎縮→無名質の菲薄化、側頭頭頂葉皮質の萎縮、側頭頭頂葉から前頭葉に及ぶびまん性萎縮。
・病初期の診断は重要。他の皮質に比べて、嗅内野皮質、海馬、扁桃体萎縮が高度の場合にはADの可能性が示唆される。→VSRADを参考にする。
・若年発症例では、海馬傍回萎縮を指摘することが難しい。→SPECT、PETを積極的に施行する。(若年例では、楔前部、後部帯状回の血流、代謝低下が顕著。)
※海馬傍回(parahippocampal gyrus)とは海馬の周囲に存在する灰白質の大脳皮質領域。大脳内側面の脳回のひとつ。
症例 70代男性
症例 70歳代男性
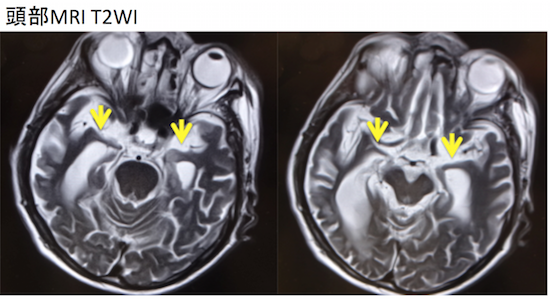
症例 80歳代女性 物忘れ。HDSR 10点
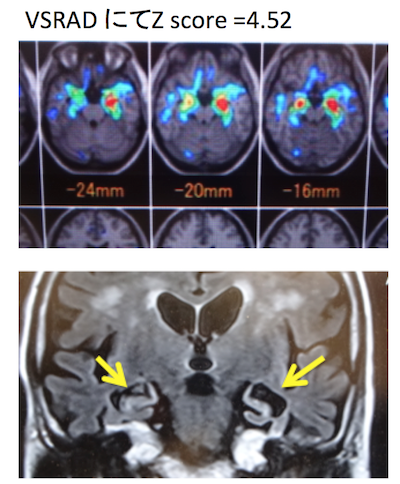
左優位に海馬および海馬傍回の萎縮あり。
軽度認知機能障害(Mild cognitive impairment:MCI)
・記憶障害で発症。それ以外の認知機能はほぼ正常。認知症の診断基準も満たさない。
・今後アルツハイマー病に進行する可能性がある高齢者群であり、約半数が4年以内にアルツハイマー病に進行する。
・発症前のアルツハイマー病(症状なし)
→軽度認知機能を伴うアルツハイマー病
→アルツハイマー病による認知症。と進行する。
・PET、SPECTやMRIで診断する。特にアミロイドPETが注目されている。
ご案内
腹部画像診断を学べる無料コンテンツ
4日に1日朝6時に症例が配信され、画像を実際にスクロールして読影していただく講座です。現状無料公開しています。90症例以上あり、無料なのに1年以上続く講座です。10,000名以上の医師、医学生、放射線技師、看護師などが参加中。胸部レントゲンの正常解剖を学べる無料コンテンツ
1日3分全31日でこそっと胸部レントゲンの正常解剖の基礎を学んでいただく参加型無料講座です。全日程で簡単な動画解説付きです。
画像診断LINE公式アカウント
画像診断cafeのLINE公式アカウントで新しい企画やモニター募集などの告知を行っています。 登録していただくと特典として、脳の血管支配域のミニ講座の無料でご参加いただけます。
